美国FIERCE BIOTECH报道,FDA近期批准了全球首个仅基于人类血管化类器官疗效数据的IND申请,证实了动物疗效(POC)测试不再是临床前研究的必选项,人类疾病模型正迎来历史性转折。本次IND(新药临床试验申请)由SillaJen公司提交,申请内容为 BAL0891与免疫检查点抑制剂联合疗法的临床试验许可。
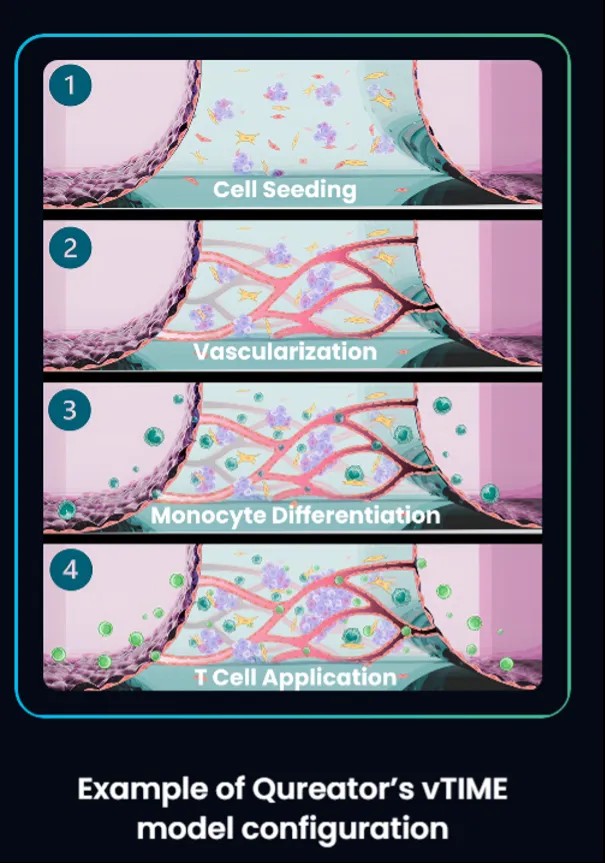
值得关注的是,本次IND申请的临床前疗效数据来源于 Qureator 公司基于器官芯片技术构建的血管化肿瘤免疫微环境模型(vTIME)。相较于传统类器官,通过器官芯片技术的加持,vTIME模型实现了人类免疫细胞与癌细胞和血管系统的有效整合,通过使免疫细胞在可灌注的血管中迁移,实现了外渗、浸润肿瘤以及三维肿瘤细胞杀伤场景的体外复现。vTIME为评估肿瘤免疫靶点和机制提供了生理相关性更高的平台。这种增强的生理相关性显著提高了预测能力,并加速了肿瘤免疫疗法的开发。同时,该平台搭载AI引擎并集成大量人类数据,可进一步提升临床前阶段数据对临床结果预测的准确性。
Qureator 公司首席执行官 Kyu Baek 博士表示:“这一里程碑事件表明,监管机构与创新企业之间的密切合作,能够加速向与人类相关的检测方式转型。通过用更具预测性、基于人类的疗效模型取代动物概念验证研究,我们正在重塑临床前数据转化为临床结果的方式。”
美国监管机构推动动物模型替代方法的里程碑事件
2022年12月
美国总统拜登签署现代化法案2.0,旨在减少药物开发过程中的动物实验
2024年12月
FDA现代化法案3.0全票通过,强制要求FDA在法案通过的6个月内更新其管理规章,以推动2022年通过的FDA现代化法案2.0(FDAMA 2.0)实施
2025年4月
FDA宣布计划逐步淘汰传统动物实验,转而采用实验室培养的类器官与器官芯片系统测试药物安全性
NIH宣布推动人体器官芯片替代动物模型
2025年7月
NIH机构宣布终止纯动物实验资助
2025年9月
NIH 设立全美首个标准化类器官建模中心,以减少对动物建模的依赖
2025年10月
FDA发布《替代和减少动物实验》,大力推动药物研发进入“无动物”新阶段