研究背景
普鲁士蓝纳米酶(Prussian Blue Nanozymes, PBNZ)以其优异的稳定性和氧化还原活性,被广泛应用于生物医药与环境治理。传统观点认为其催化反应主要通过非自由基路径进行,并且能够清除羟基自由基(·OH),从而具备抗氧化活性。这与多数铁基纳米酶通过经典Fenton路径(伴随·OH生成)存在显著差异。张宇教授团队在前期工作中揭示了PBNZ通过电子传递机制发挥多酶活性,并且可通过价带/导带双路径电子转移实现“催化自增强”。然而,其是否具备自由基生成能力仍缺乏实验证据。
研究创新
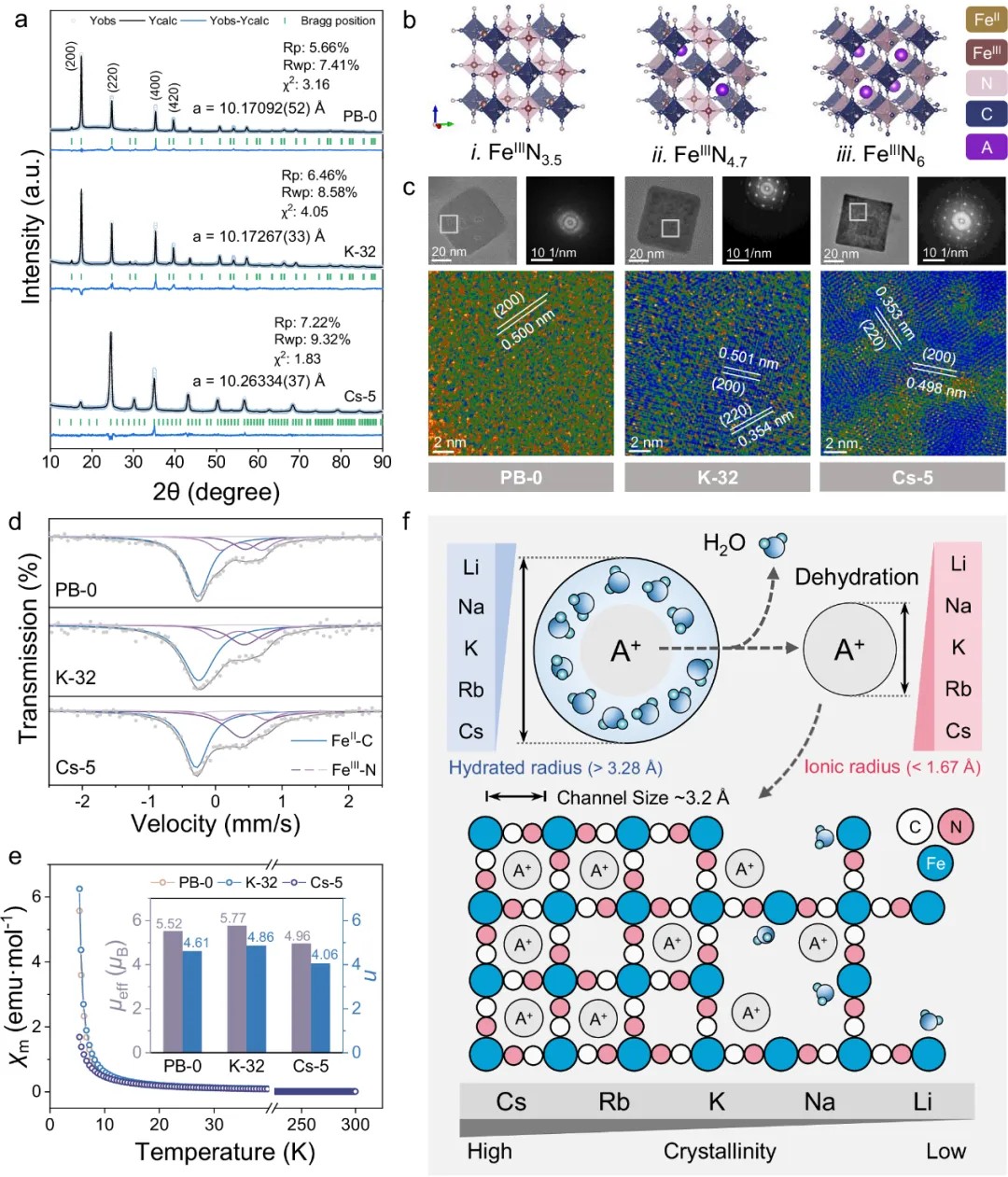
本研究以碱金属阳离子掺杂为切入点,提出通过调控Fe位点配位环境,可根本性重塑PBNZ的催化通道,实现从抗氧化型向产氧化型转变。
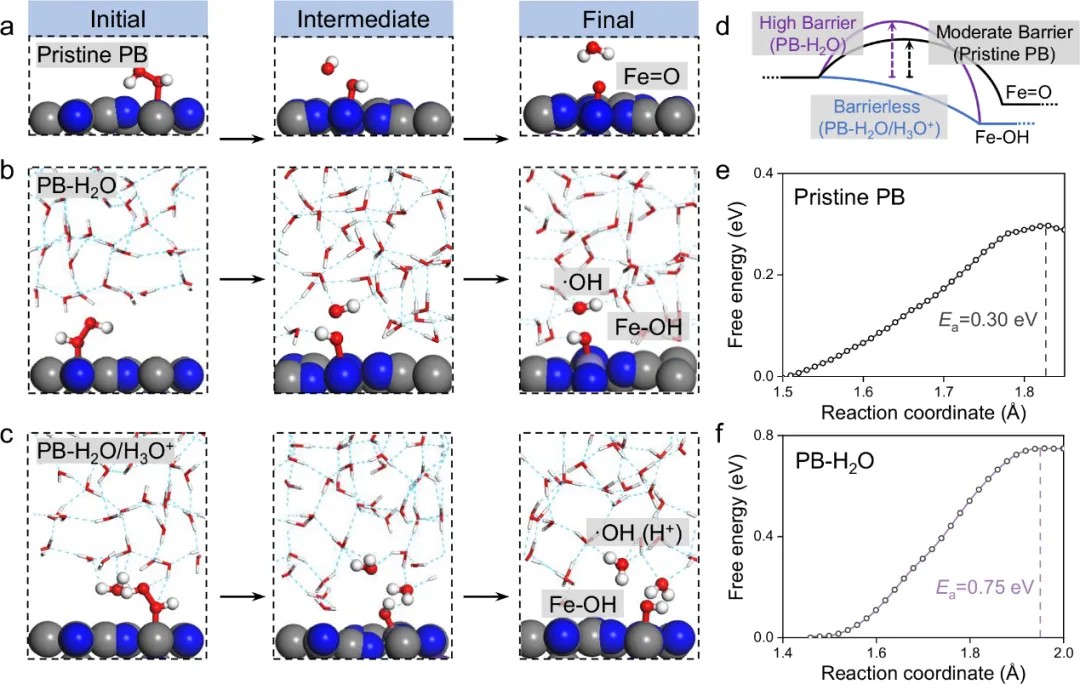
理论计算(DFT + c-AIMD)揭示(图1,2):
o 表面低配位FeN4中心主要通过氢原子转移(HAT)生成Fe=O物种;
o 表面高配位FeN5中心则在酸性条件下通过H⁺辅助直接均裂生成·OH。
实验策略实现:利用碱金属化学计量调控作用,通过改变掺杂碱金属浓度和类型实现PBNZ结晶度与Fe配位数调控,其中Cs离子掺杂PBNZ(Cs-PB)具有高配位、高结晶度、高POD活性,并且伴随·OH生成。
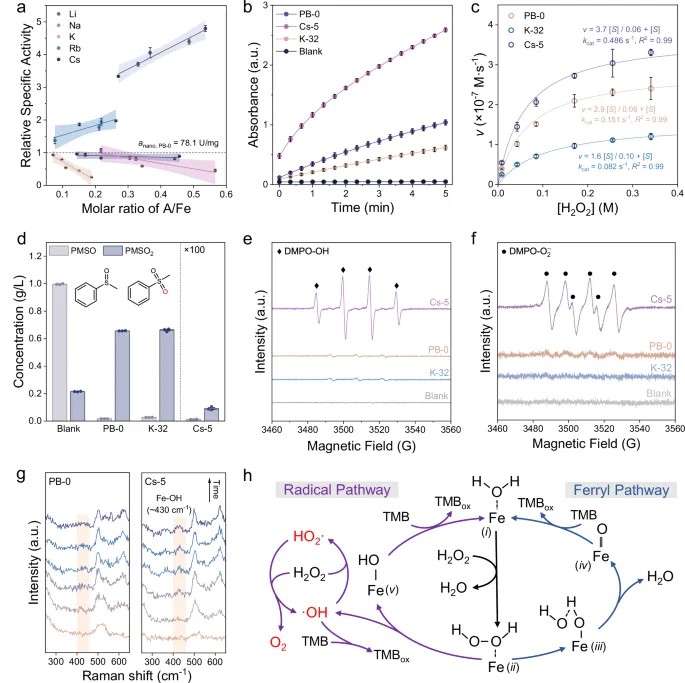
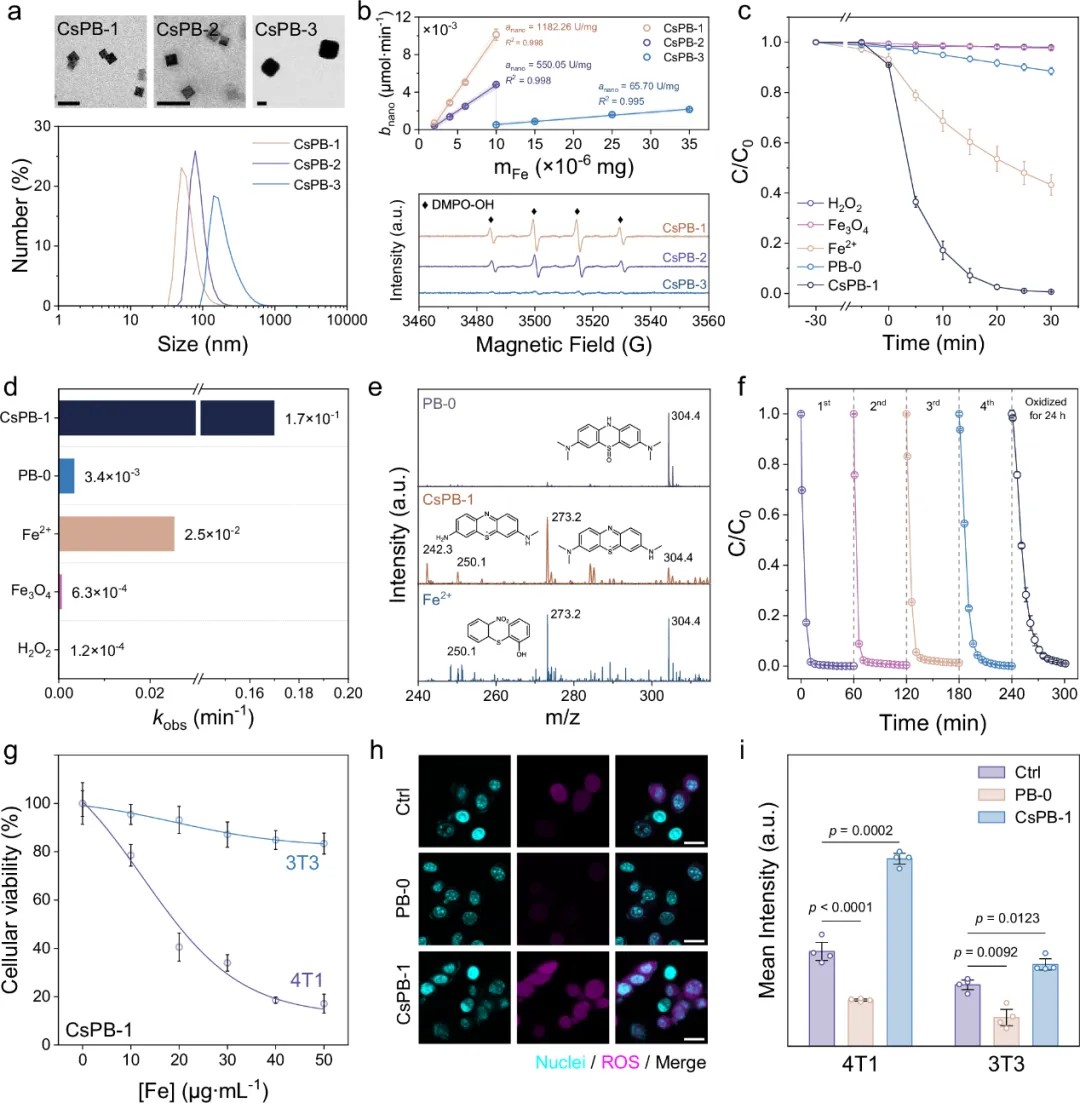
环境治理:Cs-PB/H₂O₂体系在30 min内可完全降解包括亚甲基蓝等多种污染物,速率常数达 0.17 min⁻¹,远高于Fe2+或传统PB体系(图5c-f)。
肿瘤治疗:Cs-PB在4T1肿瘤细胞中显著提升胞内ROS水平(提高2倍),细胞存活率降至20%,而对正常成纤维细胞3T3无明显毒性,实现肿瘤细胞靶向高效化学动力学治疗效果(图5g-i)。
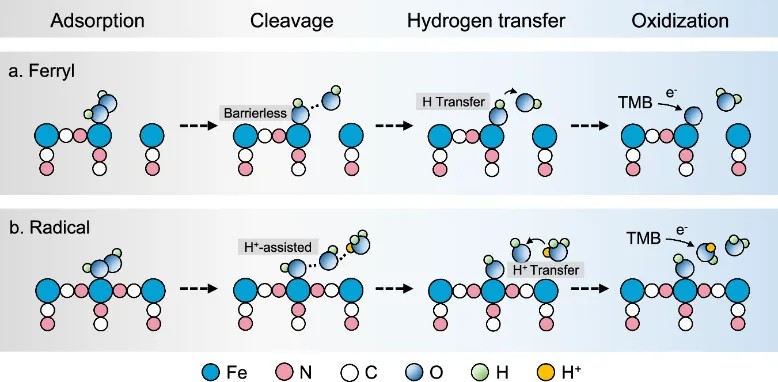
该工作首次通过配位工程实现了PBNZ催化路径的根本转变:从“自由基清除”到“自由基产生”。研究明确了两种共存的催化通路:
非自由基路径(Ferryl通路):FeN4中心主导,生成Fe=O;
自由基路径(Fenton通路):FeN5中心主导,H⁺辅助促进·OH生成。
碱金属(特别是Cs⁺)掺杂通过晶格填充与电荷平衡实现FeN4→FeN5配位数转变,从而激活自由基通路,赋予PBNZ“从抗氧化到促氧化”的调控特性。研究重新定义了普鲁士蓝纳米酶的催化本质,为纳米酶从结构设计到功能调控提供了新的理论框架,也为PBNZ在环境催化与肿瘤治疗领域开辟了双重应用前景。
相关研究以“Steering H2O2 lysis pathway for ROS generation in Prussian blue nanozymes via alkali cation doping”为题发表于Nature Communications,东南大学生物科学与医学工程学院博士生王管诚和魏小丽博士为本论文的共同第一作者,东南大学张宇教授、马明副教授和武昊安副教授为论文的共同通讯作者。